Nobel Fizyoloji ve Tıp 2019 Ödülü, William G. Kaelin Jr, Sir Peter J. Ratcliffe ve Gregg L. Semenza'ya “hücrelerin oksijen kullanılabilirliğini nasıl algıladıklarını ve adapte olduklarını keşfettiği için” ortak olarak verildi.
2019 Nobel Tıp Ödülü'nü, ABD'den William Kaelin ve Gregg Semenza ile İngiltere'den Peter Ratcliffe kazandı. Üç bilim insanı, kanser ve anemi hastalıklarına karşı mücadelede yeni stratejiler geliştirilmesi amacıyla, hücrelerin değişen oksijen seviyelerine nasıl yanıt verdiğini araştırmışlardı.
Bilimsel Arkaplan
Hücreler oksijen kullanılabilirliğini nasıl algılar ve adapte eder?
2019'da Nobel Fizyoloji veya Tıp Ödülü, William Kaelin, Jr., Sir Peter Ratcliffe ve Gregg Semenza'ya verildi. Modern biyolojinin başlangıcından bu yana yaşamı sürdürmek için oksijene duyulan ihtiyacın anlaşıldığı; ancak hücrelerin oksijen kaynağındaki değişikliklere nasıl adapte olduklarının altında yatan moleküler mekanizmalar, burada açıklanan ödüllü çalışmaya kadar bilinmiyordu. Hayvan hücreleri, etraflarındaki oksijen seviyelerinde değişiklikler olduğunda gen ifadesinde temel değişimlere uğrarlar. Gen ekspresyonundaki bu değişiklikler hücre metabolizmasını, doku yeniden modellenmesini ve hatta kalp atış hızı ve ventilasyondaki artışlar gibi organismal tepkileri değiştirir. 1990'ların başındaki çalışmalarda Gregg Semenza tanımladı ve 1995'te bu oksijene bağlı tepkileri düzenleyen bir transkripsiyon faktörü saflaştırdı ve klonladı. Hypoxia Inducible Factor için bu faktöre HIF adını verdi.ve bir ikinci, daha önce tanımlanmış ve yapısal olarak ifade edilmiş ve ARNT olarak bilinen, oksijenle regüle edilmemiş bir protein. William Kaelin, Jr., 1995'te von Hippel-Lindau tümör baskılayıcı geninin çalışmasına dahil oldu ve genin ilk tam uzunlukta klonunun izolasyonundan sonra, VHL mutant tümörijenik hücre çizgilerinde tümör büyümesini baskılayabileceğini gösterdi. Ratcliffe daha sonra 1999'da VHL ve HIF-1α arasında bir ilişki olduğunu ve VHL'nin HIF-la'nın trans-translasyonel ve oksijene duyarlı bozunmasını düzenlediğini gösterdi. Son olarak, Kaelin ve Ratcliffe grupları eşzamanlı olarak HIF-la'nın bu VHL tarafından düzenlenmesinin HIF-la'nın hidroksilasyonuna bağlı olduğunu gösterdi, kendisi oksijene bağımlı olan bir kovalent modifikasyon. Bu üç laurea'nın birleşik çalışması sayesinde, gen ekspresyonunun oksijendeki değişikliklere verdiği tepkinin, HIF transkripsiyon faktörü etkisiyle oksijene anında hücresel tepkilerin oluşmasına izin vererek, hayvan hücresindeki oksijene doğrudan bağlı olduğu gösterilmiştir.
Oksijen ve Hayvan Yaşamı
1770'lerin başlarında, İsveçli bilim adamı Carl Scheele, hesaplamalarından, hava hacminin yaklaşık dörtte birinin “feuer soft” veya “yangın havası” olarak tanımladığını; yani atmosferin, maddelerin yanmasına izin veren bileşenidir. Bu sonuçta 1777'de yayınlandı (Scheele, 1777). Esasen İngiltere'de aynı zamanda, Joseph Priestley, daha önce bilinmeyen bu gazı arındırmak için, federasyondan arındırılmış hava olarak adlandırdığı bir yöntem buldu (Priestley, 1775). Antoine Lavoisier, bu maddeyi Paris'te izole etmek için deneyler yapan Scheele ve Priestley ile eşzamanlıydı ve Lavoisier gaza bugün bildiğimiz adı verdi: oksijen (Lavoisier, 1777).
Oksijen, besin içerisindeki besinlerin ATP'ye dönüşümünü sağlayan oksidasyon reaksiyonları sırasında hayvan yaşamı için gereklidir. Aslında, hücresel koşulların mevcut oksijen miktarına ayarlanması, meta-bolizmin kontrol edilmesinde kritik bir husustur. Bu bir yüzyıldan fazla bir süredir bilinmektedir; örneğin, 1858'de Louis Pasteur, hayvan hücrelerinde karmaşık bir oksijen kullanımı dengesi olduğunu ve hücrelerin enerji değişimini sağlamak için çoklu yollar kullandığını gösteren ilk kişiydi (Pasteur, 1858). Hayvanlarda yatmakta olan oksijen algılaması altındaki mekanizmalar daha önce 75 yıldan daha önce iki Nobel Ödülü ile işaretlenmiştir: 1931'de Otto Warburg'a, hücresel solunum için enzimatik temeli keşiflerinden dolayı ve 1938'de Corneille Heymans'a. Sinir sisteminin oksijene solunum yanıtındaki rolü. Ancak,inci oksijen akısına uyarlamalar gen ekspresyonu temel seviyede ayarlanır nasıl inşa edildiği, belli değildi.
Oksijen varyasyonlarına adaptasyon
Neredeyse tüm hayvan hücrelerinde, oksijen mevcudiyetindeki değişikliklere hızlı bir şekilde tepki verme ve adapte olma yeteneği esastır. Moleküler taksonomi çalışmalarından açıkça anlaşılmaktadır ki, evrim sırasında, hayvan hücreleri kendilerini çok hücreli üç boyutlu yapılar olarak organize etmeye başladıkça, oksijen akışına verilen bu tepki, tek tek hücreler içerisinde metabolik adaptasyonlara izin veren bir hücre-özerk reaksiyondan daha fazla hale gelmiştir; ayrıca karmaşık fizyolojik tepkilerin gelişmesine de izin verdi. Hücreler, özellikle metabolik hızlarını ayarlayarak, oksijen seviyelerindeki değişikliklere birçok otomatik yoldan adapte olmaları gerekir. Bu cevabı doku ve organ düzeyinde incelediğimizde, çok hücreli organizmaların değiştirilmiş oksijen seviyelerine uyum sağlamak için her iki yeni model dokuya ihtiyaç duyduklarını buluyoruz (örneğin,
Örnek olarak: yüksek irtifadaki insanlarda, kandaki oksijen seviyelerindeki değişiklikler, eritropoietin (EPO) hormonunu üreten ve salıveren böbreklerimizdeki uzman hücreler tarafından algılanır. Bu hormon kemik iliğinde kırmızı kan hücresi sentezini (eritropoez) aktive eder. Bu reaksiyonu tetiklemenin bir yolu, düşük irtifadaki yüksek oksijen seviyelerine maruz kalmaktır: yüksek irtifada yaşamak, böbrek tarafından EPO üretimini arttırır, bu da kanımızdaki eritrosit konsantrasyonunun artmasına neden olur ve bu da daha düşük oksijen kısmi seviyesine adapte olmamıza yardımcı olur. basınçları.
Hayvanlar, düşük oksijen ortamlarına maruz kalabilir, ancak daha önemlisi, oksijen seviyeleri dokularda da değişiklik gösterir. Hayvanlarda doku oksijen seviyeleri hem uzamsal hem de zamansal olarak değişir; ve bu varyasyon normal fizyolojik olaylar sırasında (örneğin, efor sırasında iskelet kası içindeki mevcut oksijene düşer) ve ayrıca kanser ve enfeksiyon gibi patolojik süreçlerde meydana gelir. 1970'lerde ve 1980'lerde yapılan araştırmalardan, oksijen kısmi basıncındaki bu yerel ve geçici varyasyonların, gen transkripsiyonundaki değişiklikler yoluyla hem hücrelerdeki hem de dokulardaki kritik adaptif tepkileri düzenlediği açıkça ortaya çıktı. Bu gen düzenleyici tepkiler, hücresel metabolizmayı değiştirir ve anjiyogenez, iltihaplanma ve gelişme gibi çeşitli olanlar da dahil olmak üzere temel zihinsel, rejeneratif ve savunma işlemlerini kontrol eder.
Hayvan hücrelerinin farklı oksijen konsantrasyonlarını algılayabilmesi ve sonuç olarak, gen ekspresyon modellerini yeniden bağlayabilmeleri, neredeyse tüm hayvanların hayatta kalması için esastır. Bu yollar tarafından kontrol edilen oksijenle aktifleşen sinyal yolları, çok çeşitli düzenleyici ağlara ait olan en az 300 geni etkiler. Bu moleküler yolaklar organ gelişimi ve metabolik homeostazdan doku yenilenmesine ve bağışıklığa kadar çok sayıda fizyolojik süreci etkilemektedir ve kanser dahil birçok hastalıkta önemli roller oynamaktadır.
Oksijen ve eritropoietik cevap
Hayvan yaşamı için çok önemli olan herhangi bir sinyal yolu, neredeyse kesinlikle çok sayıda ince ayar tabakası ve diğer moleküler yollarla kesişme noktaları içerdiği ortaya çıkacaktır. Oksijen yanıt yolu istisna değildir. Beklendiği gibi, oksi-gen cevap düzenlemesinin moleküler detayları, şimdi 2019 Nobel Ödülü ile ödüllendirilen keşifler yapıldıktan sonra açılmasını durdurmadı. Aksine, bu önemli keşifler alanı açmış ve oksijen akısına tepki olarak büyük bir moleküler karmaşıklık ortaya çıkaran bir çalışma patlamasına yol açmıştır.
Gregg Semenza, William Kaelin ve Sir Peter Ratcliffe'nin temel keşifleri, HIF'in (hipoksi indüklenebilir faktör) transkripsiyon faktörünün hareketleri etrafında dönüyor. Bu faktörün keşfi, 1986 ve 1987 yıllarında Maurice Bondurant, Mark Koury ve Jaime Caro; çalışmaları hipoksinin böbreklerde eritropoietin hormonunun (EPO) transkripsiyonel ekspresyonunda artışa neden olduğunu gösterdi (Bondurant ve Koury, 1986; Jelkmann ve Hellwig-Burgel, 2001; Schuster ve diğerleri, 1987). Bu bulgu, 1882’ye kadar süren deneylerde ve hipoksinin kardiyovasküler etkilerini ilk kez gösteren Fransız fizyolog Paul Bert (Bert, 1878) ve yüksek irtifaya maruz kalmanın kırmızı kanı artırdığını gösteren ilk kişi oldu. hücre sayar (Bert, 1882).
HIF izolasyonu
EPO geninin hipoksinin neden olduğu bir transkripsiyonel tepki gösterdiği fark edildiğinde, bir sonraki adım, EPO gen düzenleyici bölgesinde oksijen duyarlılığından sorumlu olan gerçek DNA sekansını belirlemek oldu. Semenza, EPO geninin transkripsiyonel düzenleyici öğelerini , insan EPO genini kapsayan farklı büyüklükte DNA fragmanları klonları kullanarak transgenik farelerde izlemeye karar verdi . Semenza ve meslektaşları ilk önce EPO'yu kapsayan 4 kilobaz bir bölgenin olduğunu gösterdiler.kodlama sekansı ve bazı küçük 5 've 3' yan sekans sekansları analiz edilen tüm transgenik dokularda EPO üretimine yol açmıştır ve dolaşımdaki EPO seviyelerinin artmasına ve sonuçta ortaya çıkan bir poli-semiemiye, yani artmış kırmızı kan hücresi sayımlarına neden olmuştur (Semenza ve ark. , 1989). Daha sonra, 6 kilobaz 5 'sınırlayıcı DNA içeren daha uzun bir EPO gen yapısının böbreğe indüklenebilir EPO ekspresyonu sağlayabildiğini gösterdi (Semenza ve diğerleri, 1990). Bu çalışma, hem pozitif hem de negatif düzenleyici unsurlar dahil olmak üzere oksijene yanıtın EPO'nun karmaşık bir transkripsiyonel düzenlemesine işaret etti.
Bir yıl sonra, 1991 yılında, Semenza düzenlenmesi konusunda önemli bulu SensorMemory'den eklenen iki ek çalışmalar yayınlanan EPO 1) DNAz hipersensitivite çalışma küçük bir bölgeyi kesin olarak: gen EPO , en azından bir kaç nükleer faktör bağlı 3' yan DNA ikisi karaciğer ve böbreklerde anemi ile indüklendi; bu küçük bölge, in vitro geçici ekspresyon analizlerinde hipoksi ile indüklenebilen bir arttırıcı olarak işlev görebildi (Semenza ve diğerleri, 1991b); 2) transgenik modellerde EPO'nun transkripsiyonel düzenlemesini daha da karakterize eden bir çalışma (Semenza ve diğerleri, 1991a). Aynı zamanda, Sir Peter Ratcliffe'nin ve Jaime Caro'in laboratuvarlarının bir cis varlığına dair rapor ettiği çalışmalarraportöre oksijen duyarlılığı veren EPO geninin DNA elementi 3 ' kültürlenmiş hepatoma hücrelerine transfekte edilmiş yapılar oluşturur (Beck ve arkadaşları, 1991; Pugh ve arkadaşları, 1991).
Yukarıda özetlenen çalışma 1992'de Semenza'ya, kültürlenmiş hücrelerde hipoksi ile indüklenebilir raportör gen ekspresyonunu ortaya çıkarmak için kullanılabilecek olan EPO geninin 3'ünün ucunda yaklaşık 50 baz çift arttırıcı tanımlamak için yol açtı . Semenza'nın bir hipoksi yanıt elemanı (HRE) olarak adlandırdığı bu arttırıcı, hepatoma hücrelerinde birkaç nükleer faktörü bağladı: biri kurucu, diğeri düşük oksijen seviyeleri (hipoksi) tarafından uyarıldı. Sonuncu faktör, sonuç olarak Semenza tarafından hipoksi ile indüklenebilir faktör (HIF) olarak adlandırıldı (Semenza ve Wang, 1992).
Ratcliffe ve Semenza Hem göstermek mümkün EPO (.; Wang ve Semenza, 1993 Maxwell ve arkadaşları, 1993) 3' güçlendirici memeli hücre tiplerinin geniş bir hipoksinin neden olduğu raportör ekspresyonunu tahrik olabilir. Bu, EPO geninin oksijen regülasyonunda yer alan moleküler mekanizmanın , çeşitli yeni hayvan hücrelerinde aktif olduğunu gösterdi; bu yeni faktörün, oksijen algılaması için ortak bir hücresel makinenin bir bölümünü temsil ettiği olasılığını ortaya çıkardı.
Hipoksik HIF indüksiyonunun birçok memeli hücresinde gözlenebileceği ve sadece böbrek ve karaciğerdeki EPO üreten hücrelerin değil, daha geniş bir bilim insanı topluluğunun ilgisini ve dikkatini arttırdığı fikri. HIF'in keşfedilmesi, metabolik adaptasyonun altında yatan evrensel bir moleküler makinenin potansiyel varlığını ve doku oksijen akısına cevaben doku tadilatının indüklendiğini göstermiştir.
Bu noktada Semenza, proteini büyük miktarlarda hücre özütlerinden arındırmak için biyokimyasal bir yaklaşım benimsemiştir. Saflaştırma işlemi sırasında HIF için fonksiyonel analiz olarak, EPO’nun 3’ün arttırıcı elementine uygulanan elektroforetik mobilite kaydırma deneylerini (EMSA) kullandı.gen (Wang ve arkadaşları, 1995; Wang ve Semenza, 1995). Amino asit dizilimi ve ardından saflaştırılmış proteinlerin cDNA klonlanması, HIF'nin kendisinin, iki farklı gen ürününden oluşan bir heterodimer olduğunu ortaya koydu. Bu bileşenlerin ilki, Semenza HIF-la tarafından adlandırılan HIF faktörünün oksijene duyarlı kısmıydı; ve ikinci bileşen, başlangıçta HIF-1b olarak adlandırılan ve bu ikinci bileşenin daha önce klonlandığı ve Aril Hidrokarbon Reseptörü Nükleer Translokatör (ARNT) olarak tarif edildiği anlaşılana kadar, yapısal olarak eksprese edilmiş bir gendi. . ARNT proteini bir dizi başka faktörle heterodimerize olur ve ekspresyonu oksijene duyarlı olmadığından, HIF-la'nın HIF kompleksindeki oksijene yanıt vermenin düzenleyicisi olduğu açıkça ortaya çıktı.
HIF ailesi genişliyor
HIF-la ile yüksek derecede ilişkili bir protein, bağımsız olarak dört farklı grup, yani Yoshiaki Fujii-Kuriyama, Werner Risau, Christopher Bradfield ve Steven McKnight gibi, 1997 yılında klonlandı (Ema vd., 1997; Flamme vd. ve diğerleri, 1997; Hogenesch ve diğerleri, 1997; Tian ve diğerleri, 1997); başlangıçta hala yaygın olarak kullanılan bir tanesini (HIF-2a) içeren bir çok isme sahipti, ancak gen uygun şekilde EPAS1 olarak atandı . EPAS1 gen HIF-1 dizi homolojisi gösteren bir derecesine sahip olan bir proteini kodlayan ve aynı zamanda bir heterodimer olarak Arnt bağlanan, bu hipoksiye HIF-1 a duyarlılığını paylaşır ve esas itibarıyla aşağıdaki gibi aynı düzenleyici motiflerin her sahip HIF-1 a için.
Bununla birlikte, HIF-la ve EPAS1 arasındaki fonksiyonda önemli farklılıklar vardır. Farelerde HIF-1a geninin silinmesi, berrak bir fenotipe, yani gestasyonel ölümcül ortalığa yol açar (Iyer ve diğerleri, 1998; Ryan ve diğerleri, 1998); ancak Epas1 gen silmeleri, muhtemelen genetik arkaplandaki farklılıklar nedeniyle oldukça değişken fenotiplere sahiptir (Compernolle ve ark. 2002, Peng ve ark. 2000; Tian ve ark. 1998). Ek olarak, bazı hipoksik yanıtların yalnızca bir veya diğer oksijene duyarlı HIF izoformu tarafından kontrol edildiğine dair bir kanıt zenginliği vardır; eritropoezis, örneğin, öncelikle EPAS1 tarafından kontrol edilir görünmektedir (Fandrey, 2004).
HIF’lerin düzenlenmesi çeviri sonrasıdır ve VHL’yi içermektedir.
Ratcliffe dahil birçok laboratuvar tarafından elde edilen veriler, HIF-1α seviyelerinin, protein transkripsiyonundaki veya gen transkripsiyonundaki veya protein sentezindeki değişikliklerle değil, protein stabilitesindeki değişikliklerle düzenlendiğini göstermiştir (Huang ve diğerleri, 1998a; Kallio ve diğerleri, 1999). ; Pugh ve diğerleri, 1997; Salceda ve Caro, 1997; Srinivas ve diğerleri, 1999); Ayrıca, HIF-la'nın ubikuitin-proteazom yolu boyunca parçalandığı ve bunun oksijene bağlı bir şekilde meydana geldiği Caro ve H. Frank Bunn de dahil olmak üzere birçok grup tarafından iblis edildi. 1998b; Salceda ve Caro, 1997). Bu çalışma ayrıca, HIF-1 a'daki oksijene bağlı bozulmasından sorumlu (spesifik protein ODD bölgesi olarak adlandırılan ve hem HIF-la ve EPAS1'de bulunan) spesifik yapısal alanı da tanımlamıştır.
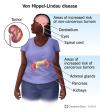
Yaklaşık bu noktada, 1995'te Kaelin grubu, VHL tümör baskılayıcı genin ilk tam uzunlukta dizisini yayınladı ve vahşi bir VHL tipi versiyonunun renal karsinoma hücre hattına yeniden dahil edilmesinin hücre hattının tümör oluşturmasını önlediğini gösterdi ( Iliopoulos ve arkadaşları, 1995). Kaelin ve diğer bazı gruplar VHL genini ve bunun bazı kanser türlerine genetik yatkınlığı olan birkaç aileye olan bağlantısını araştırıyordu. Kaelin'in makalesi, VHL'nin, aktivitesinin VHL mutasyonu olan hastalardan hücrelerin tümör büyümesini inhibe etmek için etki edebilen bir tümör baskılayıcı gen olduğunu ortaya koydu. 1996 yılında, VHL geninin karakterizasyonu sırasında, Kaelin grubu ve Mark Goldberg grubu arasındaki işbirlikçi çalışma, bir dizi HIF hedef geninin VHL mutant hücre çizgilerinde aşırı eksprese edildiğini gösterdi (Iliopoulos ve ark. 1996). .
Daha sonra VHL işlevi ile ilgili önemli bir ipucu, VHL proteinine bağlanma ortaklarının tanımlanmasıyla geldi. Richard Klausner ve arkadaşları, Kaelin ve grubu, 1995 yılında VHL'nin B ve C arasındaki transkripsiyonel uzama faktörleri ile etkileşime girdiğini bulmuşlardır (Duan ve diğerleri, 1995; Kibel ve diğerleri, 1995) ve 1997'de Klausner W. Marston Linehan ve arkadaşları, VHL'nin protein ubiquitinasyonunda rol oynayan bir faktör olan Cul-2 proteini (Pause ve diğerleri, 1997) ile bir kompleks içinde bulunduğunu gösterdi; daha sonra Kaelin tarafından çoğaltılan bir bulgu (Lonergan ve diğerleri, 1998). C ve Cul-2 uzaması, Skp1 ve Cdc53'e yapısal benzerlik gösterdiğinden, ubikuitine bağımlı proteoliz için spesifik proteinleri hedeflediği bilinen faktörler, bu gözlemler, VHL ve protein bozulması arasında potansiyel bir bağlantı olduğunu ortaya koydu.
HIF, her yerde kullanım ve VHL tarafından proteolizis hedeflenmiştir
1996-1998 yılları arasındaki dönemde HIF-la ve EPAS1'in normokside proteazomal parçalanma ile hızla ortadan kalktığı açıkken, bu sürecin hipoksi sırasında nasıl inhibe edildiği hala bilinmiyordu. Bulmacanın eksik olan bir parçası ubikuitin E3 ligazının ayrışma için HIF-la'yı hedeflemede rol aldığından şüphelenildi. Burada, Ratcliffe ve meslektaşları, VHL kompleksinin HIF-1 a proteolizinde yer aldığını gösterdikleri bir dönüm noktası makalesinde 1999 yılında önemli bir atılım sağlamıştır (Maxwell ve diğ., 1999). Bunlar ve diğerleri, VHL'nin, bu işlemde bir ubikuitin E3 ligaz kompleksinin bir tanıma bileşeni olarak etki ettiğini gösterdi (Cockman ve diğerleri, 2000; Kamura ve diğerleri, 2000; Krieg ve diğerleri, 2000; Ohh ve diğerleri, 2000; Tanimoto ve arkadaşları, 2000).
Bu noktada bulmacanın kritik ve kalan bir parçası VHL-HIF-1α etkileşiminin ve ardından HIF-1α bozulmasının oksijen ile nasıl düzenlendiği idi . Önemli olarak, Maxwell ve diğ., 1999'dan gelen makale, VHL-HIF-1a etkileşiminin hem oksijene hem de demire bağlı bir aktivite gerektirdiğine işaret etmektedir. Bu bulgu, mekanizma araştırmasını başlattı: hem HF-la'nın hem VHL bağlanmasını sağlayan oksijene bağlı kimyasal modifikasyonu hem de bu reaksiyonu katalize eden enzim (ler) için.
O zaman, oksijene bağımlı protein hidroksilasyonunun kollajen proteinlerinde meydana geldiği ve kollajen prolil-4-hidroksilazın aracılık ettiği bilinmektedir. Bu nedenle, HIF-la'da prolin kalıntılarının oksijene bağlı hidroksilasyonunun VHL bağlanmasına izin vermek için gereken konformasyonel değişikliği sağlayabileceğinden şüphelenildi. Bu durum olduğu ortaya çıktı. 2001'de, Ratcliffe ve Kaelin laboratuvarları aynı anda HIF-la'nın ODD alanı içindeki iki prolin tortusunun oksijene bağımlı 4-hidroksilasyonunun HIF transkripsiyon faktörünün VHL-kompleks bağlanmasına olan afinitesini arttırdığını bildirdi. Bunu açıklayan iki makale arka arkaya yayınlandı (Ivan ve diğerleri, 2001; Jaakkola ve diğerleri, 2001).
Oksijene bağlı anahtarlar
Prolin hidroksilasyonu oksijen gerektirir ve bu nedenle HIF-la ve EPAS1 proteinlerinin translasyon sonrası düzenlemesinin zarif mekanizması ortaya çıkarılmıştır: oksijenin yokluğunda, hiçbir hidroksilasyon meydana gelmez ve VHL HIF-1 a'yı tanımıyor; Bundan dolayı, HIF-la, her yerde bulunmaz ve proteazomal bozulmayı önler ve bozulmadan kalır. Daha sonra hipoksi ile indüklenmiş gen α programını biriktirebilir ve transkripsiyonel olarak aktive edebilir.
NOT: Oksijen seviyeleri düşük olduğunda (hipoksi), HIF-1 a, bozulmaya karşı korunur ve çekirdek içinde ARNT ile birleşir ve hipoksi düzenlenmiş genlerdeki (1) spesifik DNA sekanslarına (HRE) bağlanır. Normal oksijen seviyelerinde, HIF-la, proteazom (2) tarafından hızla bozulur. Oksijen, HIF-la (3) 'e hidroksil grupları (OH) ekleyerek bozunma işlemini düzenler. VHL proteini daha sonra, HIF-la ile oksijene bağlı bir şekilde bozunmasına yol açan bir kompleksi tanıyabilir ve oluşturabilir (4).
Ratcliffe'nin grubu ve McKnight'ın grubu bağımsız olarak HIF-la ve EPAS1'in hidroksilasyonunda rol oynayan prolil hidroksilaz (PHD) genlerini; PHD'lerin genetik izolasyonunu açıklayan bu makaleler 2001'de yayınlandı (Bruick ve McKnight, 2001; Epstein ve diğerleri, 2001). Kaelin grubu ayrıca, biyokimyasal yöntemler kullanarak kendi vakalarında PHD genlerini izole etmiş ve bu çalışmayı 2002 yılında yayınlamıştır (Ivan et al., 2002). Bu hidroksilazların tanımlanması, HIF aktivitesini arttırmak için spesifik PHD inhibitörleri yaratma olasılığını arttırdı; örneğin, anemili hastalarda EPO seviyelerini arttırmak için.
İkinci bir oksijene bağlı mekanizma, bu kez HIF-1a'nın bozulması için değil, bir transkripsiyon faktörü olarak aktivitesinin inhibisyonu için 2001'de keşfedildi. HIF inhibe edici faktör ”) (Mahon ve diğerleri, 2001). FIH aynı zamanda oksijene bağlı bir hidroksilazdır, bu durumda HIF-la ve EPASl'in N-terminal aktivasyon alanında (NTAD) bir asparagin tortusunu hidroksile eden; bu hidroksilasyon, p300 transkripsiyonel ortak aktivatörün alımına müdahale etmek için Murray Whitelaw ve Richard Bruick tarafından bulunmuştur (Lando ve diğerleri, 2002a; Lando ve diğerleri, 2002b). Bu şekilde oksijen, ODD alanının prolil-hidroksilasyonu yoluyla sadece HIF-1 a bozulmasını desteklemez, ancak, VHL'ye bağlı bozulmadan kaçan herhangi bir HIF-la veya EPASl'in transkripsiyonel fonksiyonunu da inhibe edebilir. Dolayısıyla, HIF aktivitesi oksijene bağlı translasyon sonrası inhibisyon için bir değil iki bağımsız mekanizmaya sahiptir. Bu, HIF seviyelerini düzgün bir şekilde ve hücresel oksijen seviyeleri tarafından tam olarak düzenlenmiş tutmanın mutlaka çok ince ayarlanmış bir işlem olduğunu gösterir.
HIF kontrol yolunun geniş önemi
Birçok grup tarafından yapılan çalışmalar, HIF yolunun sağlamlığını ve oksijene bağlı gen ekspresyonunu modüle etmedeki merkezi rolünü göstermiştir. Semenza, Ratcliffe ve Kaelin, orijinal eser bulmalarından bu yana merkezi figürler olmaya devam ediyor. HIF yolağının moleküler biyolojisinin daha ayrıntılı açıklanmasında yer almışlardır ve sağlık ve hastalıkta hipoksik yanıtın oynadığı fizyolojik roller hakkındaki anlayışımızı da arttırmışlardır.
HIF-la a stabilitesini düzenleyen prolin hidroksilazların keşfi, HIF seviyelerini arttırmak için hidroksilaz inhibitörlerinin aranmasını sağlamıştır; ve bu şimdi farmakolojik keşif için yeni yollar açtı (Giaccia ve ark. 2003). Aslında, PHD enzimlerini inhibe ederek HIF fonksiyonunu arttıran bir dizi potansiyel ilaç, klinik çalışmalarda zaten çok uzaktır, anemi tedavisinde klinik etkinliklerini gösteren yakın tarihli bir dizi yayın (Chen ve arkadaşları, Chen ve ark. , 2019b).
HIF yolunu engellemek için gelecekteki uygulamalar da ufukta; Bunlar, VHL mutasyonları tarafından indüklenen bazı kanserlerin ilerlemesini yavaşlatmanın bir aracı olarak öngörülmektedir. Bunlardan biri, son zamanlarda Kaelin ve meslektaşları tarafından hayvan modellerinde VHL mutant hücrelerinin tümör büyümesini yavaşlatabilecek şekilde tarif edilen spesifik bir EPAS1 fonksiyon engelleyicisidir (Cho ve diğerleri, 2016).
Farmakolojik olarak arttırılmış HIF fonksiyonu, HIF'nin bağışıklık fonksiyonu, kıkırdak oluşumu ve yara iyileşmesi kadar çeşitli fenomenler için gerekli olduğu gösterilen çok çeşitli hastalıkların tedavisinde yardımcı olabilir. Tersine, HIF fonksiyonunun inhibisyonu da birçok uygulamaya sahip olabilir: inme, kalp krizi ve pulmoner hipertansiyon gibi bazı kardiyovasküler hastalıklarda olduğu gibi birçok kanserde de HIF seviyelerinde artış görülür. Bu nedenle, bu Nobel Ödüllü keşiflerin uygulamalarının sadece başındayız, çünkü hücreler, dokular ve organizmalardaki oksijene verilen yanıtın hayvanların sahip olduğu en merkezi ve önemli fizyolojik adaptasyonlardan biri olduğu açıktır.
Kaynaklar
Beck, I., Ramirez, S., Weinmann, R., and Caro, J. (1991). Enhancer element at the 3′-flanking region controls transcriptional response to hypoxia in the human erythropoietin gene. J Biol Chem 266, 15563-15566.
Bert, P. (1878). La Pression Barométrique: Recherches de Physiologie Expérimentale. (Paris: G. Masson).
Bert, P. (1882). Sur la richesse en hemoglobine du sang des animaux vivant sur les haut lieux. Comptes rendus de l’Académie des Sciences 94, 805-807.
Bondurant, M.C., and Koury, M.J. (1986). Anemia induces accumulation of erythropoietin mRNA in the kidney and liver. Mol Cell Biol 6, 2731-2733.
Bruick, R.K., and McKnight, S.L. (2001). A conserved family of prolyl-4-hydroxylases that modify HIF. Science 294, 1337-1340.
Chen, N., Hao, C., Liu, B.C., Lin, H., Wang, C., Xing, C., Liang, X., Jiang, G., Liu, Z., Li, X., et al. (2019a). Roxadustat Treatment for Anemia in Patients Undergoing Long-Term Dialysis. N Engl J Med 381, 1011-1022.
Chen, N., Hao, C., Peng, X., Lin, H., Yin, A., Hao, L., Tao, Y., Liang, X., Liu, Z., Xing, C., et al. (2019b). Roxadustat for Anemia in Patients with Kidney Disease Not Receiving Dialysis. N Engl J Med 381, 1001-1010.
Cho, H., Du, X., Rizzi, J.P., Liberzon, E., Chakraborty, A.A., Gao, W., Carvo, I., Signoretti, S., Bruick, R.K., Josey, J.A., et al. (2016). On-target efficacy of a HIF-2alpha antagonist in preclinical kidney cancer models. Nature 539, 107-111.
Cockman, M.E., Masson, N., Mole, D.R., Jaakkola, P., Chang, G.W., Clifford, S.C., Maher, E.R., Pugh, C.W., Ratcliffe, P.J., and Maxwell, P.H. (2000). Hypoxia inducible factor-alpha binding and ubiquitylation by the von Hippel-Lindau tumor suppressor protein. J Biol Chem 275, 25733-25741.
Compernolle, V., Brusselmans, K., Acker, T., Hoet, P., Tjwa, M., Beck, H., Plaisance, S., Dor, Y., Keshet, E., Lupu, F., et al. (2002). Loss of HIF-2alpha and inhibition of VEGF impair fetal lung maturation, whereas treatment with VEGF prevents fatal respiratory distress in premature mice. Nat Med 8, 702-710.
Duan, D.R., Pause, A., Burgess, W.H., Aso, T., Chen, D.Y., Garrett, K.P., Conaway, R.C., Conaway, J.W., Linehan, W.M., and Klausner, R.D. (1995). Inhibition of transcription elongation by the VHL tumor suppressor protein. Science 269, 1402-1406.
Ema, M., Taya, S., Yokotani, N., Sogawa, K., Matsuda, Y., and Fujii-Kuriyama, Y. (1997). A novel bHLH-PAS factor with close sequence similarity to hypoxia-inducible factor 1alpha regulates the VEGF expression and is potentially involved in lung and vascular development. Proc Natl Acad Sci U S A 94, 4273-4278.
Epstein, A.C., Gleadle, J.M., McNeill, L.A., Hewitson, K.S., O’Rourke, J., Mole, D.R., Mukherji, M., Metzen, E., Wilson, M.I., Dhanda, A., et al. (2001). C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation. Cell 107, 43-54.
Fandrey, J. (2004). Oxygen-dependent and tissue-specific regulation of erythropoietin gene expression. Am J Physiol Regul Integr Comp Physiol 286, R977-988.
Flamme, I., Frohlich, T., von Reutern, M., Kappel, A., Damert, A., and Risau, W. (1997). HRF, a putative basic helix-loop-helix-PAS-domain transcription factor is closely related to hypoxia-inducible factor-1 alpha and developmentally expressed in blood vessels. Mech Dev 63, 51-60.
Giaccia, A., Siim, B.G., and Johnson, R.S. (2003). HIF-1 as a target for drug development. Nat Rev Drug Discov 2, 803-811.
Hogenesch, J.B., Chan, W.K., Jackiw, V.H., Brown, R.C., Gu, Y.Z., Pray-Grant, M., Perdew, G.H., and Bradfield, C.A. (1997). Characterization of a subset of the basic-helix-loop-helix-PAS superfamily that interacts with components of the dioxin signaling pathway. J Biol Chem 272, 8581-8593.
Huang, L.E., Gu, J., Schau, M., and Bunn, H.F. (1998a). Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proc Natl Acad Sci U S A 95, 7987-7992.
Huang, L.E., Gu, J., Schau, M., and Bunn, H.F. (1998b). Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proceedings of the National Academy of Sciences of the United States of America 95, 7987-7992.
Iliopoulos, O., Kibel, A., Gray, S., and Kaelin, W.G., Jr. (1995). Tumour suppression by the human von Hippel-Lindau gene product. Nat Med 1, 822-826.
Iliopoulos, O., Levy, A.P., Jiang, C., Kaelin, W.G., Jr., and Goldberg, M.A. (1996). Negative regulation of hypoxia-inducible genes by the von Hippel-Lindau protein. Proc Natl Acad Sci U S A 93, 10595-10599.
Ivan, M., Haberberger, T., Gervasi, D.C., Michelson, K.S., Gunzler, V., Kondo, K., Yang, H., Sorokina, I., Conaway, R.C., Conaway, J.W., et al. (2002). Biochemical purification and pharmacological inhibition of a mammalian prolyl hydroxylase acting on hypoxia-inducible factor. Proc Natl Acad Sci U S A 99, 13459-13464.
Ivan, M., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S., and Kaelin, W.G., Jr. (2001). HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing. Science 292, 464-468.
Iyer, N.V., Kotch, L.E., Agani, F., Leung, S.W., Laughner, E., Wenger, R.H., Gassmann, M., Gearhart, J.D., Lawler, A.M., Yu, A.Y., et al. (1998). Cellular and developmental control of O2 homeostasis by hypoxia-inducible factor 1 alpha. Genes & Development 12, 149-162.
Jaakkola, P., Mole, D.R., Tian, Y.M., Wilson, M.I., Gielbert, J., Gaskell, S.J., Kriegsheim, A., Hebestreit, H.F., Mukherji, M., Schofield, C.J., et al. (2001). Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 292, 468-472.
Jelkmann, W., and Hellwig-Burgel, T. (2001). Biology of erythropoietin. Adv Exp Med Biol 502, 169-187.
Kallio, P.J., Wilson, W.J., O’Brien, S., Makino, Y., and Poellinger, L. (1999). Regulation of the hypoxia-inducible transcription factor 1alpha by the ubiquitin-proteasome pathway. Journal of Biological Chemistry 274, 6519-6525.
Kamura, T., Sato, S., Iwai, K., Czyzyk-Krzeska, M., Conaway, R.C., and Conaway, J.W. (2000). Activation of HIF1alpha ubiquitination by a reconstituted von Hippel-Lindau (VHL) tumor suppressor complex. Proc Natl Acad Sci U S A 97, 10430-10435.
Kibel, A., Iliopoulos, O., DeCaprio, J.A., and Kaelin, W.G., Jr. (1995). Binding of the von Hippel-Lindau tumor suppressor protein to Elongin B and C. Science 269, 1444-1446.
Krieg, M., Haas, R., Brauch, H., Acker, T., Flamme, I., and Plate, K.H. (2000). Up-regulation of hypoxia-inducible factors HIF-1alpha and HIF-2alpha under normoxic conditions in renal carcinoma cells by von Hippel-Lindau tumor suppressor gene loss of function. Oncogene 19, 5435-5443.
Lando, D., Peet, D.J., Gorman, J.J., Whelan, D.A., Whitelaw, M.L., and Bruick, R.K. (2002a). FIH-1 is an asparaginyl hydroxylase enzyme that regulates the transcriptional activity of hypoxia-inducible factor. Genes Dev 16, 1466-1471.
Lando, D., Peet, D.J., Whelan, D.A., Gorman, J.J., and Whitelaw, M.L. (2002b). Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch. Science 295, 858-861.
Lavoisier, A. (1777). Mémoire sur la combustion en général. Mémoires de l’Académie des sciences, 592.
Lonergan, K.M., Iliopoulos, O., Ohh, M., Kamura, T., Conaway, R.C., Conaway, J.W., and Kaelin, W.G., Jr. (1998). Regulation of hypoxia-inducible mRNAs by the von Hippel-Lindau tumor suppressor protein requires binding to complexes containing elongins B/C and Cul2. Mol Cell Biol 18, 732-741.
Mahon, P.C., Hirota, K., and Semenza, G.L. (2001). FIH-1: a novel protein that interacts with HIF-1alpha and VHL to mediate repression of HIF-1 transcriptional activity. Genes Dev 15, 2675-2686.
Maxwell, P.H., Pugh, C.W., and Ratcliffe, P.J. (1993). Inducible operation of the erythropoietin 3′ enhancer in multiple cell lines: evidence for a widespread oxygen-sensing mechanism. Proc Natl Acad Sci U S A 90, 2423-2427.
Maxwell, P.H., Wiesener, M.S., Chang, G.W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R., and Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature 399, 271-275.
Ohh, M., Park, C.W., Ivan, M., Hoffman, M.A., Kim, T.Y., Huang, L.E., Pavletich, N., Chau, V., and Kaelin, W.G. (2000). Ubiquitination of hypoxia-inducible factor requires direct binding to the beta-domain of the von Hippel-Lindau protein. Nat Cell Biol 2, 423-427.
Pasteur, L. (1858). Nouveaux faits concernant l’histoire de la fermentation alcoolique. Comptes Rendus Chimie 47, 1011-1013.
Pause, A., Lee, S., Worrell, R.A., Chen, D.Y., Burgess, W.H., Linehan, W.M., and Klausner, R.D. (1997). The von Hippel-Lindau tumor-suppressor gene product forms a stable complex with human CUL-2, a member of the Cdc53 family of proteins. Proc Natl Acad Sci U S A 94, 2156-2161.
Peng, J., Zhang, L., Drysdale, L., and Fong, G.H. (2000). The transcription factor EPAS-1/hypoxia-inducible factor 2alpha plays an important role in vascular remodeling. Proc Natl Acad Sci U S A 97, 8386-8391.
Priestley, J. (1775). Experiments and observations on different kinds of air (London: Printed for J. Johnson, No. 72, in St. Paul’s Churchyard).
Pugh, C.W., O’Rourke, J.F., Nagao, M., Gleadle, J.M., and Ratcliffe, P.J. (1997). Activation of hypoxia-inducible factor-1; definition of regulatory domains within the alpha subunit. J Biol Chem 272, 11205-11214.
Pugh, C.W., Tan, C.C., Jones, R.W., and Ratcliffe, P.J. (1991). Functional analysis of an oxygen-regulated transcriptional enhancer lying 3′ to the mouse erythropoietin gene. Proc Natl Acad Sci U S A 88, 10553-10557.
Ryan, H.E., Lo, J., and Johnson, R.S. (1998). HIF-1 alpha is required for solid tumor formation and embryonic vascularization. EMBO J 17, 3005-3015.
Salceda, S., and Caro, J. (1997). Hypoxia-inducible factor 1alpha (HIF-1alpha) protein is rapidly degraded by the ubiquitin-proteasome system under normoxic conditions. Its stabilization by hypoxia depends on redox-induced changes. J Biol Chem 272, 22642-22647.
Scheele, C. (1777). d. Königl. Schwed. Acad. d. Wissenschaft. Mitgliedes, Chemische Abhandlung von der Luft und dem Feuer. (Uppsala and Liepzig: Magnus Swederus, Buchhändler).
Schuster, S.J., Wilson, J.H., Erslev, A.J., and Caro, J. (1987). Physiologic regulation and tissue localization of renal erythropoietin messenger RNA. Blood 70, 316-318.
Semenza, G.L., Dureza, R.C., Traystman, M.D., Gearhart, J.D., and Antonarakis, S.E. (1990). Human erythropoietin gene expression in transgenic mice: multiple transcription initiation sites and cis-acting regulatory elements. Mol Cell Biol 10, 930-938.
Semenza, G.L., Koury, S.T., Nejfelt, M.K., Gearhart, J.D., and Antonarakis, S.E. (1991a). Cell-type-specific and hypoxia-inducible expression of the human erythropoietin gene in transgenic mice. Proc Natl Acad Sci U S A 88, 8725-8729.
Semenza, G.L., Nejfelt, M.K., Chi, S.M., and Antonarakis, S.E. (1991b). Hypoxia-inducible nuclear factors bind to an enhancer element located 3′ to the human erythropoietin gene. Proc Natl Acad Sci U S A 88, 5680-5684.
Semenza, G.L., Traystman, M.D., Gearhart, J.D., and Antonarakis, S.E. (1989). Polycythemia in transgenic mice expressing the human erythropoietin gene. Proc Natl Acad Sci U S A 86, 2301-2305.
Semenza, G.L., and Wang, G.L. (1992). A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation. Mol Cell Biol 12, 5447-5454.
Srinivas, V., Zhang, L.P., Zhu, X.H., and Caro, J. (1999). Characterization of an oxygen/redox-dependent degradation domain of hypoxia-inducible factor alpha (HIF-alpha) proteins. Biochem Biophys Res Commun 260, 557-561.
Tanimoto, K., Makino, Y., Pereira, T., and Poellinger, L. (2000). Mechanism of regulation of the hypoxia-inducible factor-1 alpha by the von Hippel-Lindau tumor suppressor protein. EMBO Journal 19, 4298-4309.
Tian, H., Hammer, R.E., Matsumoto, A.M., Russell, D.W., and McKnight, S.L. (1998). The hypoxia-responsive transcription factor EPAS1 is essential for catecholamine homeostasis and protection against heart failure during embryonic development. Genes Dev 12, 3320-3324.
Tian, H., McKnight, S.L., and Russell, D.W. (1997). Endothelial PAS domain protein 1 (EPAS1), a transcription factor selectively expressed in endothelial cells. Genes Dev 11, 72-82.
Wang, G.L., Jiang, B.H., Rue, E.A., and Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proceedings of the National Academy of Sciences of the United States of America 92, 5510-5514.
Wang, G.L., and Semenza, G.L. (1993). General involvement of hypoxia-inducible factor 1 in transcriptional response to hypoxia. Proc Natl Acad Sci U S A 90, 4304-4308.
Wang, G.L., and Semenza, G.L. (1995). Purification and characterization of hypoxia-inducible factor 1. Journal of Biological Chemistry 270, 1230-1237.